Хімічна основа успадковування
Ядро кожної клітини має хромосоми, у яких розміщені гени, що складаються із сеґментів дезоксирибонуклеїнової кислоти (ДНК), де накопичується та зберігається генетична інформація. Сучасні молекулярні дослідження показали, що гени не розташовані як суміжні гранулі на генонемі. Вони відокремлені один від одного довгими ланцюгами ДНК, які іноді називають зчепленими ДНК, і функція яких до цього часу ще не відома.
СТРУКТУРА ДНК
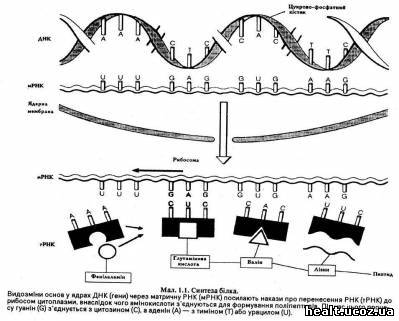
ДНК складається з двох полінуклеотидних ланцюгів, що скручені у подвійну спіраль (мал. 1.1). Кожний нуклеотид містить азотову основу, молекулу цукру (дезоксирибозу) та молекулу фосфату. Азотовими основами ДНК є аденін і гуанін (пурини) та цитозин і тимін (піримідини). Пурин одного ланцюга завжди з'єднується з піримідином з іншого ланцюга. З'єднання азотових основ відбувається за правилом: гуанін з одного ланцюга з'єднується тільки з розміщеним у іншому ланцюгу цитозином, а аденін завжди з'єднується з тиміном. Під час поділу ядра відокремлюються дві нитки молекули ДНК, й внаслідок специфічного з'єднання основ ланцюг формує свій комплемент. Таким чином під час поділу клітини генетична інформація консервується і переноситься до кожної дочірньої клітини.
Головна функція гена полягає у синтезі білка шляхом різноманітних комбінацій 20-ти різних амінокислот. Генетична інформація накопичується у межах молекули ДНК у вигляді триплетного коду таким чином, що видозміни трьох основ обумовлюють структуру однієї амінокислоти.
СТРУКТУРА РНК
Якщо ДНК здебільшого знаходять у хромосомах, рибонуклеїнова кислота (РНК) головним чином міститься у ядрі та цитоплазмі. Будова РНК подібна до будови ДНК (мал. 1.1): обидві нуклеїнові кислоти містять аденін, гуанін та цитозин, але у РНК замість тиміну міститься урацил, який, відповідно, містить цукрову рибозу.
 мал. 1.1
мал. 1.1
Транскрипція
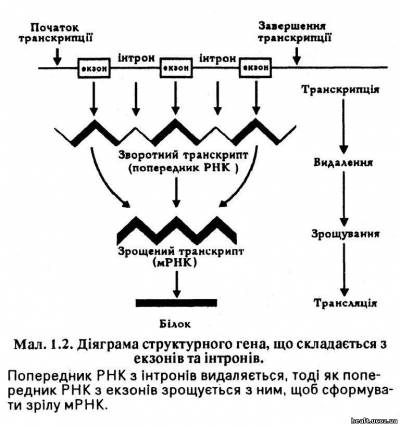
Закладена у коді ДНК інформація транскрибується з однієї нитки до особливого типу РНК, яку називають матричною РНК (мРНК). Кожна мРНК формується особливим геном таким чином, що кожна основа, яка міститься у молекулі мРНК, доповнює відповідну основу, що розміщена у ДНК гена: цитозин з'єднується з гуаніном, тимін — з аденіном, а аденін — з урацилом, тому що останній міститься у РНК замість тиміну. Проте дослідження показали, що гени складаються з екзонів та інтронів, що формують попередника РНК, якого видаляють, тоді як попередники РНК з екзонів з'єднуються й утворюють зрілу молекулу мРНК (мал. 1.2). Порушення процесу зрощування здатне відчутно вплинути на генний продукт, й нині вважають, що вони є чинником деяких генетичних хвороб (наприклад, окремих видів таласемії).
 мал. 1.2
мал. 1.2
Трансляція
Далі мРНК переходить до цитоплазми, де з'єднується з рибосомами, у яких відбувається синтеза білка. У рибосомах мРНК формує матрицю для послідовного зв'язку окремих амінокислот. Необхідно зауважити, що фермент (зворотна транскриптаза) здатний каталізувати синтезу ДНК з РНК. За допомогою цього ферменту з мРНК можна сформувати комплементарну копію ДНК (кДНК). Цю кДНК можна використовувати, наприклад, для проведення генної аналізи.
У цитоплазмі міститься ще одна форма РНК, так звана транспортна РНК (тРНК). У цитоплазмі кожна амінокислота з'єднується з відповідною тРНК. Інший кінець молекули тРНК складається з трьох основ, які з'єднуються з відповідними основами мРНК. Таким чином певний триплет мРНК з'єднується через тРНК з відповідною амінокислотою. Рибосома просувається вздовж мРНК, немов "застібка — блискавка", формуючи зібрані амінокислоти у поліпептидний ланцюг.
Зміна (мутація) пари основ молекули ДНК може призвести до різноманітних порушень. Коли змінений триплет кодує одну й ту саму амінокислоту, мутацію, звичайно, виявити майже неможливо. Таким чином відбуваються близько 20—25 відсотків можливих одноосновних мутацій. Іноді одноосновна мутація може призвести до з'яви триплету, який кодує іншу амінокислоту, внаслідок чого відбуваються зміни у білку. Останній може зберегти свою біологічну активність (наприклад, ферментативну), але набуде інших фізико-хемічних властивостей. Наприклад, може змінитися рівень електрофоретичної моторности або стабільности, внаслідок чого він швидше руйнується. Таке явище дуже часто спостерігають при гемоглобінозах, під час яких порушення гемоглобіну можна виявити лише методою аналізи зміненої електрофоретичної моторности. Проте при заміщенні у білку однієї амінокислоти на іншу можливе зниження чи навіть повна відсутність його біологічної активности. Тому природжені порушення обміну речовин характеризуються зменшенням рівня вмісту певного ферменту, бо він не синтезується, або синтезується, але знижує активність. Внаслідок своєї нестабільності він швидше руйнується.